
غلظت مولار و غلظت معمولی
چکیده:
یکی دیگر از کمیت های بیان غلظت در شیمی محلول ها، غلظت مولار (مولی) و غلظت معمولی می باشند. در این درس به این دو روش خواهیم پرداخت.
شرح درس:
مهم ترین روش ها برای بیان غلظت محلول های آبی، غلظت معمولی و غلظت مولار می باشند.
غلظت معمولی (C) : جرم ماده حل شونده ( به گرم) موجود در یک لیتر محلول را غلظت معمولی می نامند که واحد آن بر اساس این تعریف گرم بر لیتر می باشد.

غلظت مولار (M) : مولاریته یا غلظت مولار به تعداد مول های ماده حل شونده در یک لیتر محلول گفته می شود.

همان طور که در فصل استوکیومتری گفته شد، در محاسبات استوکیومتری از غلظت مولار استفاده می شود. برای تهیه محلول یک مولار از یک ترکیب باید یک مول از آن را وزن کرده و به مقدار کافی به آن آب اضافه کنیم تا دقیقا یک لیتر محلول بدست آید. اما زمانی که یک محلول مایع تهیه میکنیم، حجم محلول به ندرت مساوی مجموع حجم های اجزا خالص سازنده آن می شود و معمولا حجم نهایی محلول بیشتر یا کمتر از مجموع حجم های اجزا سازنده آن است. از این رو برای تهیه یک محلول معین عملا نمیتوانیم مقدار حلال لازم را پیشبینی کنیم. برای تهیه محلول های مولار و سایر محلول هایی که بر اساس حجم کل می باشند، معمولا از بالن های حجمسنجی استفاده میشود. در این روش برای تهیه یک محلول مقدار دقیق ماده حل شونده را در بالن جای میهیم و با دقت آن قدر آب میافزائیم و بطور مداوم و با احتیاط هم میزنیم تا سطح محلول به خط نشانهای که روی گردن بالن مشخص شده برسد.

رقیق کردن محلول:
هنگامی که یک محلول غلیظ را توسط آب مقطر رقیق می کنیم غلظت مولی آن کاهش می یابد. در این شرایط از رابطه زیر می توان استفاده کرد:
M1 : غلظت مولی محلول غلیظ اولیه
M2 : غلظت مولی محلول رقیق حاصل
V1 : حجم محلول غلیظ اولیه
Vw: حجم آب مقطر اضافه شده
V1 +Vw بیانگر حجم نهایی محلول رقیق شده می باشد.

نکته: برای تبدیل غلظت معمولی به غلظت مولار و یا بالعکس می توان از رابطه زیر استفاده کرد:
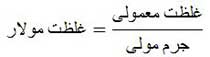
مرکز یادگیری سایت تبیان – تهیه و تنظیم: مهسا شاه حسینی

















